Esta entrada trata de....
.....experiencias que abren paso a MODELOS ATÓMICOS.
Para esto, vamos a ver unas preguntas y vamos a responderlas explorando por Internet.....
PREGUNTA 1:
¿Qué es y qué supuso la Experiencia de los Rayos Catódicos para Thomson?
-Los rayos catódicos son corrientes de electrones, que se observan en tubos de vacío, de cristal que se empujan por lo menos con dos electrodos, un cátodo y un ánodo. Si las paredes internas de vidrio detrás del ánodo están cubiertas con un material fluorescente , brillan intensamente. Esto significa que la causa de la emisión de luz son los rayos emitidos por el cátodo al golpear la capa fluorescente. Los rayos viajan hacia el ánodo en línea recta, y continúan mas allá de él durante una cierta distancia.
-Thomson determinó la relación entre la carga y la masa de los rayos catódicos, al medir cuánto se desvían por un campo magnético y la cantidad de energía que llevan . Encontró que la relación carga/masa era más de un millar de veces superior a la del ión Hidrógeno, lo que sugiere que las partículas son muy livianas o muy cargadas.
PREGUNTA 2:
¿Cómo llega Rutheford a la idea de su modelo atómico?
La importancia del modelo de Rutherford residió en proponer por primera vez la existencia de un núcleo en el átomo (término que, paradójicamente, no aparece en sus escritos). Lo que Rutherford consideró esencial, para explicar los resultados experimentales, fue "una concentración de carga" en el centro del átomo, ya que sin ella, no podía explicarse que algunas partículas fueran rebotadas en dirección casi opuesta a la incidente. Este fue un paso crucial en la comprensión de la materia, ya que implicaba la existencia de un núcleo atómico donde se concentraba toda la carga positiva y más del 99,9% de la masa. Las estimaciones del núcleo revelaban que el átomo en su mayor parte estaba vacío.
Rutherford propuso que los electrones orbitarían en ese espacio vacío alrededor de un minúsculo núcleo atómico, situado en el centro del átomo. Además se abrían varios problemas nuevos que llevarían al descubrimiento de nuevos hechos y teorías al tratar de explicarlos:
- Por un lado se planteó el problema de cómo un conjunto de cargas positivas podían mantenerse unidas en un volumen tan pequeño, hecho que llevó posteriormente a la postulación y descubrimiento de la fuerza nuclear fuerte, que es una de las cuatro interacciones fundamentales.
- Por otro lado existía otra dificultad proveniente de la electrodinámica clásica que predice que una partícula cargada y acelerada, como sería el caso de los electrones orbitando alrededor del núcleo, produciría radiación electro magnéticca, perdiendo energía y finalmente cayendo sobre el núcleo. Las leyes de Newton, junto con las ecuaciones de Maxwell del electromagnetismo aplicadas al átomo de Rutherford llevan a que en un tiempo del orden de
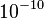 s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo.4 Se trata, por tanto de un modelo físicamente inestable, desde el punto de vista de la física clásica
s, toda la energía del átomo se habría radiado, con la consiguiente caída de los electrones sobre el núcleo.4 Se trata, por tanto de un modelo físicamente inestable, desde el punto de vista de la física clásica
Según Rutherford, las órbitas de los electrones no están muy bien definidas y forman una estructura compleja alrededor del núcleo, dándole un tamaño y forma algo indefinidas. Los resultados de su experimento le permitieron calcular que el radio atómico era diez mil veces mayor que el núcleo mismo, y en consecuencia, que el interior de un átomo está prácticamente vacío.

